http://www.nsfc.gov.cn/publish/portal0/tab448/info74098.htm
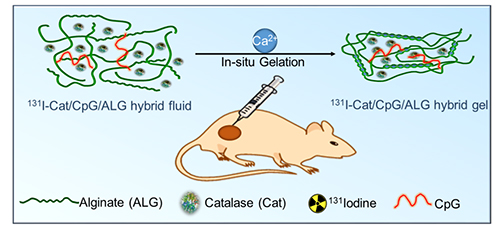
图1. 碘131标记的过氧化氢酶(蛋白)、免疫佐剂CpG(核酸)以及海藻酸钠(多糖)复合物肿瘤内局部注射原位成胶示意图。
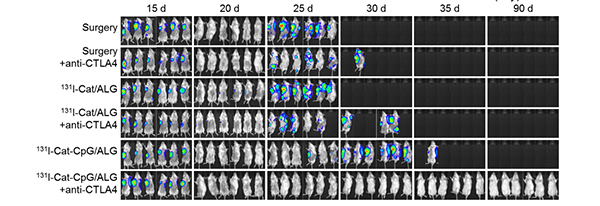
图2. 基于生物材料的放射免疫联合治疗可有效抑制肿瘤转移。图中各组小鼠都在第16天接受各种疗法的治疗(包括手术、手术联合免疫治疗、放疗、放疗联合免疫治疗等),虽然第20天时几乎所有组的原位乳腺癌肿瘤都消失了,但除了放射免疫联合治疗组(最后一组)外,其他各组中隐匿的转移肿瘤细胞都导致了后续的肿瘤全身转移和小鼠死亡。
在国家杰出青年基金项目(项目编号:51525203)等资助下,苏州大学刘庄教授、杨凯副教授团队报道了一种基于生物材料的新型肿瘤放射免疫联合治疗策略。研究成果以 “Combined Local Immunostimulatory Radioisotope Therapy and Systemic Immune Checkpoint Blockade Imparts Potent Antitumour Responses”(局部免疫刺激核素内放疗联合免疫检查点阻断诱发强烈抗肿瘤反应)为题,于2018年7月16日在Nature Biomedical Engineering(《自然-生物医学工程》)上在线发表。论文链接:https://www.nature.com/articles/s41551-018-0262-6。
手术、化疗和放疗是临床肿瘤治疗的“三板斧”,但是,肿瘤一旦发生转移,现有治疗方案都有很多局限。放射治疗分为以大型射线机为放射源的外放疗和以植入体内的放射性同位素为源的内放疗,在临床中得到广泛的应用。但值得注意的是,氧分子是增强放射引起癌细胞损伤的重要因素,然而大部分实体肿瘤中都存在乏氧区域,这部分癌细胞对放疗耐受;另一方面,放疗通常用来局部治疗实体肿瘤,难以有效清除转移后的弥散病灶。
研究团队将有治疗功能的放射性同位素碘131标记在过氧化氢酶上,然后将其与免疫佐剂CpG以及海藻酸钠混合得到复合注射液对肿瘤进行原位治疗。通过海藻酸钠原位成胶可将其他组分固定于瘤内,在较低的放射性剂量下,通过单次注射可在小鼠肿瘤模型、人源异种移植模型以及兔肿瘤模型上完全杀灭原位实体瘤;在此基础上,CpG作为免疫佐剂可与内放疗后肿瘤残留物相互作用,产生肿瘤特异性的免疫反应,通过联用免疫检查点抑制剂,可利用机体自身的免疫系统追击远端转移的肿瘤细胞,从而抑制肿瘤转移;随后,研究人员还观察到一种类似疫苗的免疫记忆效应,能够保护小鼠不受肿瘤复发的侵袭。
该方法理论上可适用于多种类型的实体瘤,有可能给那些已经发生肿瘤转移且不能通过手术或化疗治愈的中晚期患者带来新的机遇。该策略中所用的试剂组分都是基于天然生物材料,具有很好的生物相容性,有利于未来临床转化。目前该技术有效性仅在小动物模型上得到了验证,未来能否应用于临床并实现预期疗效,有待进一步验证。